

細胞機能学分野では以下のような研究を行っています (1)生体内脂質ホメオスタシスの分子基盤 (2)SUMO修飾によるクロマチン構造と転写の制御機構 (1)生体内脂質ホメオスタシスの分子基盤 脂肪は生物にとって最も効率的なエネルギー源であり、その貯蔵と利用は個体レベルで厳密に制御されています。この過程は、脂肪組織における脂肪蓄積と必要に応じた動員、および各組織における脂肪の合目的的な利用が、緊密に連携することによって成立しています。私たちの研究室では、この制御機構についていくつかの視点から研究を進めています。 A. 脂肪滴 (Lipid Droplet) と脂肪滴結合タンパク質の機能 過剰に摂取したエネルギーは体内でグリコーゲンとして貯蔵されるほか、中性脂肪として脂肪細胞内の脂肪滴(lipid droplet)とよばれる器官に蓄積されます。脂肪滴は、トリアシルグリセロールやコレステロールエステルからなるコア(芯)がリン脂質一重層に覆われた構造をもち、脂肪細胞だけでなく、全身の細胞に広く存在しています。肥満は、脂肪細胞の脂肪滴に中性脂肪が過剰に蓄積した状態であり、脂肪肝は肝臓で脂肪滴が肥大した状態です。脂肪滴は単に余分な脂肪が集まっている場所ではなく、その表面では厳密な制御のもと脂肪の蓄積と分解が行われており、体内の脂質ホメオスタシスに重要な役割を果たしています。脂肪滴は細胞内で一定の構造と特定の機能をもつ細胞小器官(オルガネラ)なのです。
特に、新規のPATファミリーとして私たちが報告をしたMLDP (Perilipin 5/Plin5) について、ノックアウトマウスを作製し、その生理的機能を解析しています。また、脂肪細胞においてペリリピンと相互作用する因子としてCGI-58を同定し、その脂肪分解における役割について研究しています。 これらの研究についてもう少し詳しく知りたい方はこちら(詳細)をご覧ください。 脂肪滴における脂肪蓄積機構の破綻は、脂肪組織だけでなく体内のあらゆる器官で異常を引き起こします。実際に、動脈硬化症、糖尿病、魚鱗癬など多くの疾患との関連が知られています。 関連する最近の業績 B. 核内レセプターとその関連因子による転写調節機構 (2)SUMO修飾によるクロマチン構造と転写の制御機構 DNAからの情報を読み取る転写反応は、DNAに直接結合する転写因子以外にも、ヒストン修飾酵素や染色体構造調節因子などさまざまな機能をもつ転写共役因子群の協調的な作用によって厳密に制御されています。さらに、最近の研究から核マトリクスや核膜、核膜孔などの核の基本的骨組みとなるタンパク質因子も、クロマチンと相互作用することで転写調節に関わっていることが明らかになりつつあります。こうした核内の様々な因子間の相互作用の一部は、リン酸化、メチル化などのタンパク質の翻訳後修飾により制御されています。我々の研究室で同定した転写因子hDREFは、翻訳後修飾のひとつであるSUMO化を触媒する酵素活性を有しています。我々は、hDREFによるSUMO化修飾の意味を明らかにすることを目的に、主にヒト培養細胞を用いた生化学的、細胞生物学的アプローチからの研究を行っています。 1.転写因子hDREFの構造と標的遺伝子 10
bpからなる標的配列 (5’-TGTCG(C/T)GA(C/T)A-3’) に結合し、結合配列の下流に存在する遺伝子の転写を促進します。hDREFの結合配列は368個のヒト遺伝子プロモーターに見つかっています。
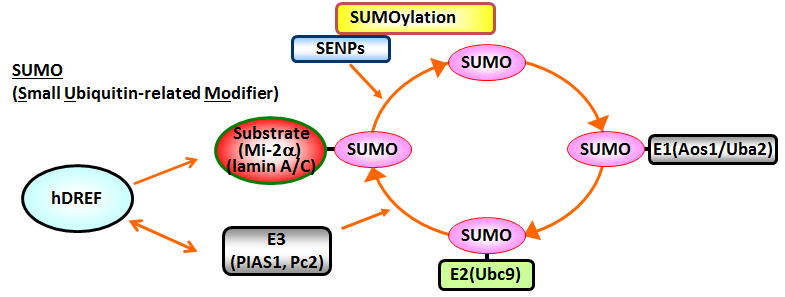 図3.SUMO 化経路とhDREF hDREFは基質特異的なSUMO修飾を行うE3酵素として働く。 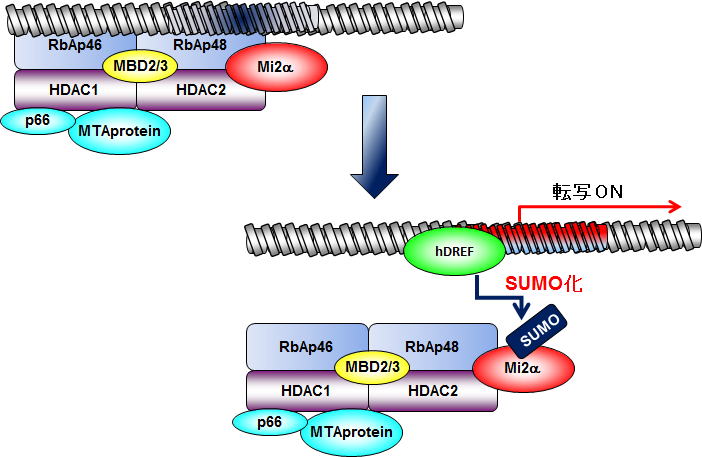 図4.hDREFのSUMO化を介した転写促進モデル hDREFは転写を負に調節する染色体構造調節因子Mi-2αを特異的にSUMO化する。SUMO化されたMi-2αは クロマチンから解離しやすくなり、結果として転写が促進される。 4.核ラミナとクロマチンのSUMO化依存的な相互作用を明らかにする hDREFによりSUMO化が促進されるLamin Aは、核膜直下に存在する網目構造の核ラミナの主要構成因子です。核ラミナは核膜、クロマチンの両者との相互作用を介して、核内でのクロマチンの位置情報、核膜直下でのヘテロクロマチン形成、転写調などの反応を制御しています(図5)。我々は、Lamin Aに焦点を絞り、核膜とクロマチンの相互作用の分子機構を明らかにしたいと考えています。Lamin Aポリペプチドは自身がSUMO化修飾されるほかに、SUMOタンパク質と結合するSIM (SUMO interacting motif)配列をもっています(図6)。 SIMを含むタンパク質はSUMO化タンパク質と相互作用して、SUMO修飾に依存的な複合体の形成を制御することがわかっています。現在、Lamin AのSUMO化やSIM配列依存的に相互作用する核内タンパク質の同定を行っています。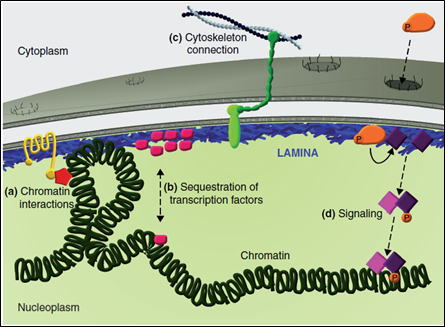 図5.核ラミナとクロマチンの相互作用 図5.核ラミナとクロマチンの相互作用
図6.Lamin Aポリペプチドの構造
(文責:大隅) |
|
|
|