研究内容
細胞周期制御:遺伝情報維持機構の解明
~染色体複製のライセンス化制御:染色体の複製を一回のみ行なう仕組み~
〈研究の概要〉
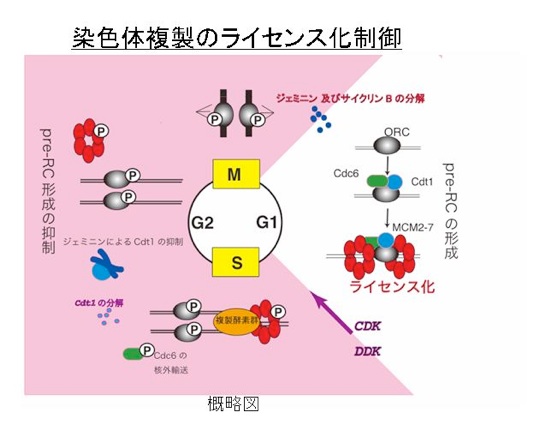
細胞は、細胞周期を繰り返し増殖します。新しく生み出された細胞が、親と同一の遺伝情報を受け継ぐことが、種の保存や個体形成の基本となります。遺伝情報が維持されるためには、染色体は正確に一度だけ複製されて、そのあと、正確に2つの娘細胞に分配されなければなりません。細胞周期において、もし複製が終了しないうちにM期に進行したり、再複製が起こったりすると、染色体分配や遺伝子数の異常が生じ、細胞死・発生異常あるいは細胞のがん化をもたらすと予想されます。細胞は、このような異常を抑制する機能を持っており、我々は、染色体の複製を“一回のみ”に制御する機構(ライセンス化制御)の解明に主眼をおき、主にライセンス化因子Cdt1の機能解析を行っています。G1期において、染色体上の染色起点に、DNA二重らせんを巻き戻すヘリカーゼMCM2-7が結合してライセンス化されます。この過程においてCdc6とCdt1が必須です。我々は、これらの因子を高発現すると過剰複製が起ることを、酵母を用いて世界で初めて明らかにしました。その後ヒトCdt1をクローニングし、ほ乳類細胞におけるライセンス化の制御機構の解明を行っています。特に、Cdt1はS期開始後、ユビキチン化されて速やかに分解されることを発見しました。Cdt1の機能発現、分解に関る因子の解析を通して、正確に一度だけ複製される分子機構を明らかにすることにより、遺伝情報維持機構の解明を目指しています。
I. はじめに
細胞周期において染色体はS期に複製され、2つの娘細胞に均等に分配されます。この時、染色体は一度だけ複製され、何度も複製されることは有りません。何度も複製されると、染色体分配が異常になり、たとえ2つの娘細胞ができたとしても受け取る遺伝情報は親と同一ではなくなってしまいます。
では、どうして、一回のみ複製されるのでしょうか?
たまたま、そうなっているのか、あるいは再複製を抑制する制御機構が有るのでしょうか?
’98年、BlowとRaskeyは、染色体複製のライセンス化因子というものを提唱しました。この因子は、染色体複製の開始に必要な因子で、M期が終ると染色体に結合しますが、一旦複製が開始すると消費されるか機能が無くなってしまいます。その結果、一度複製された領域にライセンス化因子が再び作用することがないので、M期が終るまで2度と複製されないように制御されると言うものです。
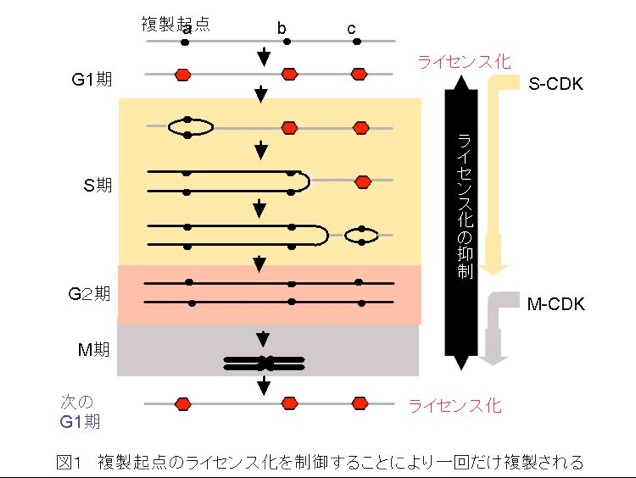
II. 複製起点のライセンス化を制御することにより一回だけ複製される
まず、BlowとRaskeyの考えを基に染色体複製の開始点(複製起点)のライセンス化を制御することにより、一回だけに複製が限定されるしくみを説明します(図1)。
III. pre-RC形成によるライセンス化の確立のしくみ
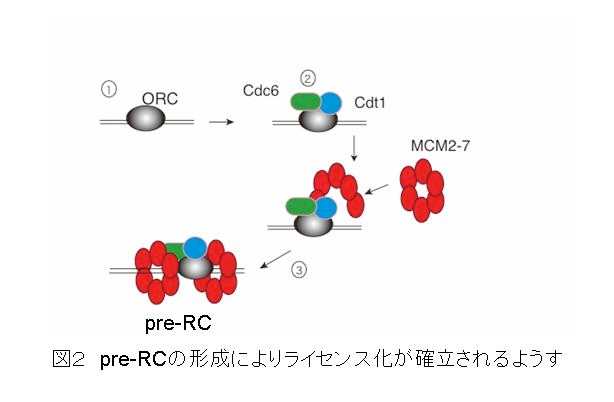
では、どのようにしてG1期にだけ複製起点がライセンス化可能になるように制御されているのでしょうか?それにはまず、ライセンス化の実態を分子レベルで明らかにする必要があります。’91年のStillmannのグループによる複製起点に結合するORC(origin recognition complex)の発見にはじまり、酵母やアフリカツメガエル卵の抽出液を用いた遺伝学、生化学的研究により、ライセンス化が確立するうえで、4つの因子が関わることが明らかとなってきました。それらは、前述のORCとCdc6(Cell division cycle6)、Cdt1(Cdc10 dependent transcript 10)、MCM2-7(mini-chromosome maintenance2-7)です。図2に示すように、まず染色体上の複製開始部位となるところにORCが結合します(図2①)。続いて、そこにCdc6とCdt1が結合し(図2②)、これらの因子がMCM2-7を染色体上にロードします(図2③)。このとき、環状のMCM2-7が開いてDNAを取り囲むように閉じて染色体に結合すると考えられています。MCM2-7は、複製起点あたり数分子ロードされるようです。このようにできた複合体をpre-RC(pre-replicative complex:複製開始前複合体)とよび、複製起点のライセンス化に対応します。MCM2-7は、DNA2重ラセンを巻き戻すDNAヘリケースとして機能することが示されています。複製は、まず2重ラセンを巻き戻すことから開始することを考えると、G1期にMCM2?7を染色体にロードして、複製開始可能な状態を整えることが、ライセンス化と言えます。これら、ORC、Cdc6、Cdt1、MCM2-7をライセンス化因子とよんでいます。(図2)
IV. S期開始とライセンス化の抑制
増殖している細胞では、M期が終わり、G1期に入った頃にはすでにライセンス化が確立しています。動物細胞ではそれから10時間程経つと、S-CDKが活性化され、複製が開始します。複製の開始にはもう一つのキナーゼ、DDK(Dbf4-dependent kinase)の活性化も必要です。この2つのキナーゼの活性化により、MCM2-7などのタンパク質がリン酸化され、複製が始まると考えられています。
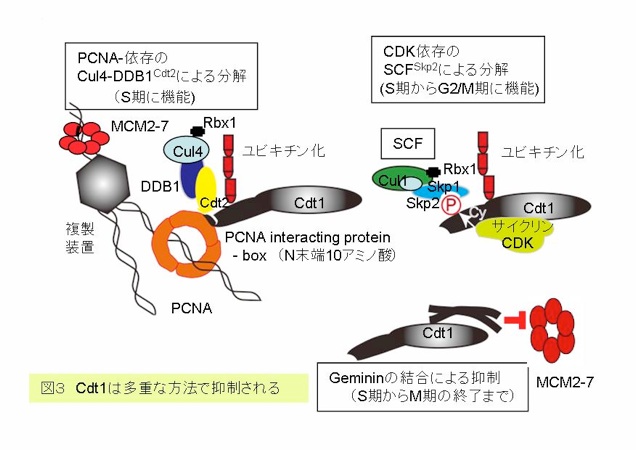
複製が始まると、MCM2-7はヘリカーゼの主体となって、複製フォークとともに複製起点から離れて行きます。その結果、複製起点は、非ライセンス化状態になります。これが、図1で複製された領域の複製起点が、赤のライセンス化状態から、黒の非ライセンス化状態に変わった状態に対応します。他のライセンス化因子は、複製起点が再度ライセンス化されることのないよう、制御されなければなりません。生物種によって異なりますが、特に、Cdc6やCdt1が、分解や核外への排除によって不活性化されることが示されています(概略図参照)。このときCdc6やCdt1がCDKによりリン酸化されることにより、分解や核外への排除のシグナルになります。例えば、酵母のCdc6やヒトCdt1は、CDKによりリン酸化されると、ユビキチンリガーゼSCF(別名CRL1)により認識され、ユビキチン化を受け、プロテアソームで分解されます。CDKは、複製を開始させると同時に、ライセンス化因子を不活化することにより再複製を抑制します。細胞周期において、S期の開始に働くS-CDKに続き、G2期の終わりにM-CDKが活性化されてM期が開始します。従って、S期が始まってM期が終るまでライセンス化因子は機能できません(概略図及び図1)。CDKによる再複製抑制の重要性は、分裂酵母においてG2期でM-CDKの活性を無くしてしまう(M期サイクリンを無くす)と、再度ライセンス化がおこり、S期が繰り返されることにより示されています。 高等動物細胞になると、CDKによる制御に加えて、さらに再複製を抑制する機構が備わっています。それは、Cdt1の機能をより厳密に抑制するものです。一つは、Cdt1に直接結合してその働きを阻害する分子で、ジェミニンと呼ばれています。ジェミニンは、S期になると出現し、2量体でCdt1に結合し、M期が終るときに分解されます。さらに最近、Cdt1は前述のSCFだけでなく、別の酵素によってもユビキチン化を受けて分解されることが分かってきました。このときに働くユビキチンリガーゼは、Cul4-DDB1Cdt2(別名CRL4-Cdt2)複合体です。この酵素が機能する時、PCNAを必要とします。PCNAはリング状構造をしていてDNAを通すように結合してDNAポリメラーゼの働きを補助する因子として見つかってきたものです。Cdt1のN末端には、PCNAと結合する配列(PIP ボックス:PCNA interacting protein box)があり、複製が開始してPCNAがDNAにロードされると、Cul4-DDB1Cdt2複合体と結びつけてユビキチン化されるように働いています。一方、SCFSkp2(CRL1-Skp2)は、CDKによってリン酸化された別の部位を認識してCdt1に結合してユビキチン化します。このようにCdt1は、ジェミニンによる阻害と2つの独立に働く分解システムにより、厳密に制御されています(図3)。
<研究内容>
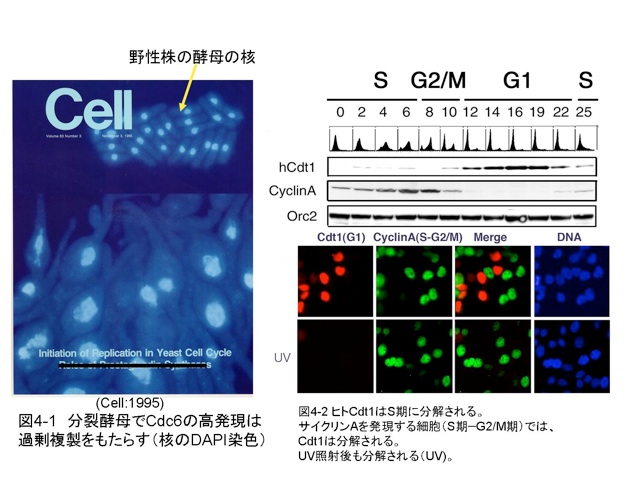
我々は、分裂酵母をモデル生物として、Cdc6(分裂酵母ではCdc18とよばれる)単独あるいはCdc6とCdt1を一緒に高発現すると、染色体の過剰複製が起こること(図4-1)を見つけ、Cdc6やCdt1の機能を制御することが、再複製の抑制に重要であることを報告しました。酵母で見られた過剰な複製がヒト細胞で起こると、染色体異常を引き起こし細胞のがん化につながるのではないかと考え、ヒトCdt1をクローニングして解析を進めてきています。細胞周期での発現を調べると、S期に分解されることが分かり(図4-2)、分解のしくみを調べることにより、CDKに依存したSCFSkp2(別名CRL1-Skp2)
残念ながら、Cdt2が関わってくることは、その後、別のグループによって報告されましたが。ライセンス化因子の中でも、Cdt1は図3にまとめたように、2重3重にその機能が綿密に抑制されていることから、Cdt1の機能制御がいかに大切であるかを物語っています。細胞のがん化は、染色体異常を伴います。最近の研究で、オンコジンの刺激などでCdc6やCdt1の発現が上がると、過剰複製が原因と思われるDNA損傷が起こり、細胞はがん化を抑制するための防御手段として細胞老化(セネセンス)を誘導すること、さらにCdc6やCdt1の高発現が続くようだと、染色体異常が誘発されがん化が引き起こされることが報告されつつあります。従って、Cdt1の分解系に異常をきたすと、がん化を促すとも考えられます。
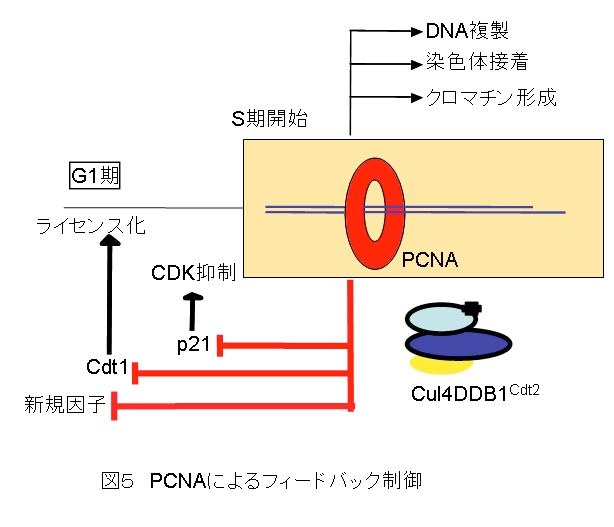
最近、CDKインヒビターp21も、Cdt1と同様にPCNA-Cul4DDB1Cdt2(CRL4-Cdt2)系により分解されることを報告しました。これらを基に、図5のように、S期が開始すると、染色体に結合したPCNAは、染色体の複製やクロマチンの形成を補助すると同時に、S期では有害なCdt1やp21を分解して細胞周期が正しく進行するようフィードバック制御の役割も果たしていると考えています。このとき図3のように、Cdt1の分解にCul4-DDB1Cdt2複合体が関わっていることが分かってきていますが、DNAポリメラーゼやリガーゼなど多数のPCNA結合因子がある中で、Cdt1やp21のみが染色体上でどのように認識されて、分解されてしまうのかよくわかりません。また、Cdt1は、UV照射などのDNA傷害が起こったときも、PCNA依存的にCul4DDB1Cdt2により分解されますが、どのような生理学的意味があるのか不明です。
これらのことを研究することにより、再複製が抑制され遺伝情報が正しく維持される機構をさらに明らかにしたいと思っています。これまで、分子生物学的細胞生物学的手法を用いて研究を行ってきましたが、生化学の方法も取り入れて、研究を進めて行きたいと考えています。