シグナル伝達による細胞制御:細胞の骨(細胞骨格)と皮(膜脂質)による細胞機能の制御を明らかにする
~機能脂質であるイノシトールリン脂質がになう細胞内シグナル伝達のしくみ~
〈研究の概要〉
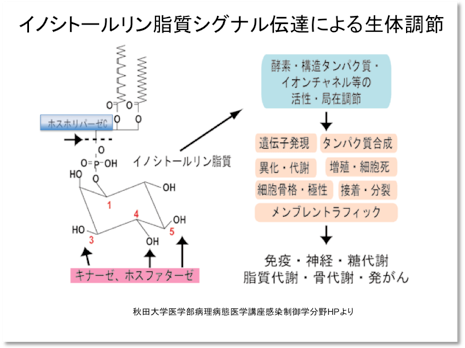
イノシトールリン脂質(PI)は細胞膜やオルガネラ膜を構成するリン脂質の中では全体の10%にも満たないマイナーな構成因子です。しかし、その親水性の頭部であるイノシトールという環状アルコールのヒドロキシル基は3、4、5位で可逆的なリン酸化を受け、8種類のPIを生じます。細胞内には様々なPI結合タンパク質が存在し、それらの活性や局在を制御することで、PIは広汎な生体機能の調節に関与します。PIの相互変換には24の反応経路を考えることができ、それぞれ変換酵素が存在します。相互変換とともに重要なのはPIの分解であり、私たちはPIのひとつであるPIP2という脂質を分解するホスホリパーゼC(PLC)というタンパク質に注目しています。これらの変換酵素や分解酵素の精緻な制御を介してPIは細胞骨格の変化や細胞分化・増殖の調節を行っています。また、PIP2がPLCによって分解されて生じるイノシトール三リン酸(IP3)は細胞内Ca2+の恒常性に重要な働きをするセカンドメッセンジャーとして働きます。IP3はさらにリン酸化をうけてイノシトール六リン酸(IP6)やピロリン酸化をうけてIP7やIP8を生じます。これらのイノシトールリン酸(IP)の種類は膨大で、六リン酸化合物までで64種類、もし、すべてのヒドロキシル基がピロリン酸化までを受けるとすると、なんと729種類にもなります。実際に生体内で働いている高次リン酸化IPは現在のところIP8までしかわかっていませんが、IP6は動物では抗がん作用を示し、植物では発芽時に種子に蓄積することが知られています。IP7やIP8の研究も最近急速に発展しています。
私たちは、「PLC異常によるPI代謝の乱れはどのような細胞機能異常や病態を招くのか?」、「PLC結合タンパクの一部にみられる抗がん活性はどのような分子機構によって担われているのか?」といった点に興味をもって研究を進めています。これまで主にデルタ型と呼ばれるPLCに着目した解析を進めるとともに、デルタ型PLCに結合するSTART-GAPと私たちが名付けたタンパク質(これは「がん研究」の世界ではDLCという名前で呼ばれています)の構造や細胞内における分布やその制御機構を調べ、これらの疑問に答える興味深い知見を得ています。
これらの結果を基礎として、PIP2やPLCを標的とした、あるいは、START-GAP/DLCを利用した心臓病治療薬、抗がん剤などの開発を計画しています。私たちのこれまでの成果と今後の目標を以下に示します。
I. PLCの異常と病態
真核細胞で進化的に最も基本的な細胞である酵母にはPLCの遺伝子は1つしかありません。その遺伝子の欠損や、活性を消失する遺伝子変異を持つ酵母は正常な生育をしません。ほ乳類の6つのPLCファミリーの中でデルタ型PLCは酵母PLCに最も近い構造を持っています。私達は、デルタ型PLCが細胞外刺激応答に応じて細胞膜から細胞質へ、そして細胞質内と細胞核の間を行き来することを見いだし、その分子機構を明らかにしてきました。細胞膜への結合には、プレクストリンホモロジー(PH)ドメインというPIP2に強く結合する領域が重要であり、その構造について詳しく調べました。疾病との関係では、孤発性(家族性でない)アルツハイマー症のある患者さんのデルタ型PLCにこのドメインに遺伝子変異があり、PIP2との結合とPLC活性が著しく低くなっていることが解りました。また、ヒト遺伝性高血圧症のモデル動物である高血圧自然発症ラットでは、正常血圧ラットと比較すると触媒部位にアミノ酸置換をともなう遺伝子変異(ミスセンス変異)があることがわかりました。試験管内の実験では変異を持った酵素も正常酵素もほぼ同様の活性を示しますが、ラットがこの変異をゲノムに持つことと血圧値が負に相関することから、生理的にはPLCが血圧の重要な制御因子になっていると考えられます。さらに最近、日本人に多い冠攣縮性狭心症と呼ばれる心臓病の患者さんのグループで、デルタ型PLCのミスセンス変異がみつかりました。この変異はPHドメインでも触媒ドメインでもなく、EFハンドモチーフというCa2+を結合する部分にありますが、この変異をもったPLCはPIP2分解活性を亢進します。私たちはこの変異を持つデルタ型PLCの構造を詳しく調べ、活性に影響を及ぼす分子機構を明らかにしようと考えています。もし、この変異をもった患者さんにデルタ型PLCを標的とした治療を施せれば、心臓病の治療にとって大きな進歩となることでしょう。
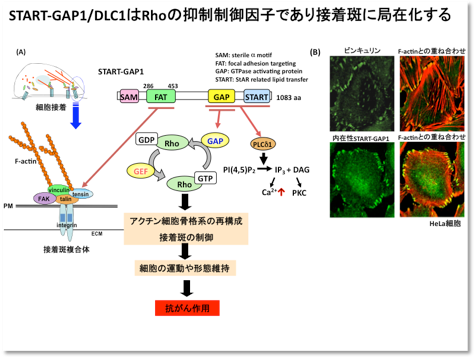
II. デルタ型PLCの結合タンパク質START-GAP/DLCは新しい抗がん遺伝子産物である
1995年、私たちの共同研究者である本間博士らはデルタ型PLCの結合タンパク質であるSTART-GAP1のcDNAをラット脳よりクローニングしました。STARTというのはこのcDNAがコードするタンパク質がSTARTドメインという脂質結合部位(未確定)を持つこと、また、アクチン細胞骨格系を制御する低分子量Gタンパク質であるRhoやCdc42を抑制するGTPアーゼ活性化タンパク(GAP)であることを表しています。START-GAP1はPLCファミリーの中でデルタ型PLCのみに結合し、その活性を亢進します。その後、1998年にアメリカ国立がんセンターのPopescue博士らは、ヒト肝臓がんにおいて欠損している染色体領域を絞り込み、それがラットSTART-GAP1に相同なタンパク質をコードするということでDLC(Delete in Liver Cancer)1という名前をつけました。今では、肝臓がんばかりでなく、大腸がん、乳がん、前立腺がんなど多くの腫瘍でDLC1やその相同遺伝子であるDLC2やDLC3の欠損や発現抑制がみられ、特にDLC1は腫瘍マーカーのひとつとして認知されつつあります。私たちはSTART-GAP/DLCが細胞の形態や運動性に重要な影響を与えることに焦点をあて、その抗がん作用を明らかにしようと考えています。私たちはSTART-GAP1/DLC1が細胞の形態維持や運動性に重要な接着斑とよばれる領域に局在化することを見つけました。その局在化の分子機構を明らかにする過程で、テンシンやビンキュリンなど他の接着斑構成タンパク質と相互作用する部位を決めることができました。がんの症状が重くなるのには、細胞の異常増殖だけでなく、変形して病巣に浸潤したり、運動によって転移したりすることが必要で、その際、接着斑形成の異常も起こっているものと思われます。つまり、前述のがんの診断ばかりでなく、がん細胞の形態や運動を制御する因子を開発するという視点からもSTART-GAP/DLCの研究を進める必要があります。