|

Ca2+/CaM埶懚惈僾儘僥僀儞僉僫乕僛
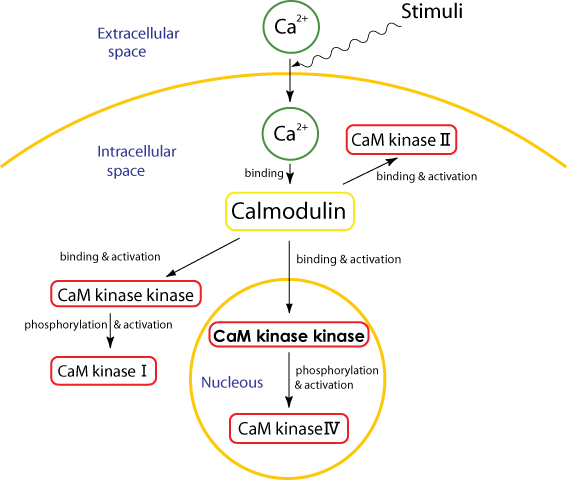
丂丂丂擼偵偍偗傞僇儖僔僂儉僀僆儞埶懚惈僔僌僫儖揱払偵娭傢傞懡婡擻惈僾儘僥僀儞僉僫乕僛偲偟偰"CaM僉僫乕僛嘥丆嘦丆媦傃嘩"偑懚嵼偡傞偙偲偑抦傜傟偰偄傞丏偝傜偵嬤擭丆CaM僉僫乕僛嘥偲嘩傪儕儞巁壔偟偰妶惈壔偡傞CaM僉僫乕僛僉僫乕僛乮埲壓丆CaMKK乯偑敪尒偝傟偨丏僇儖僔僂儉僀僆儞傪夘偡傞僔僌僫儖揱払宯偵偙偺僾儘僥僀儞僉僫乕僛僇僗働乕僪偑廳梫側栶妱傪壥偨偟偰偄傞丏恾-1偵CaM僉僫乕僛僇僗働乕僪傪帵偡丏巋寖偵墳摎偟偰恄宱嵶朎撪偺僇儖僔僂儉僀僆儞擹搙偑忋徃偟丆僇儖儌僕儏儕儞(CaM)偑妶惈壔偝傟傞丏CaM偼CaM僉僫乕僛II傪妶惈壔偡傞偲偲傕偵丆CaM僉僫乕僛僉僫乕僛(CaMKK)偺妶惈壔傪夘偟偰CaM僉僫乕僛I偲CaM僉僫乕僛IV傪妶惈壔偡傞丏
恾-1
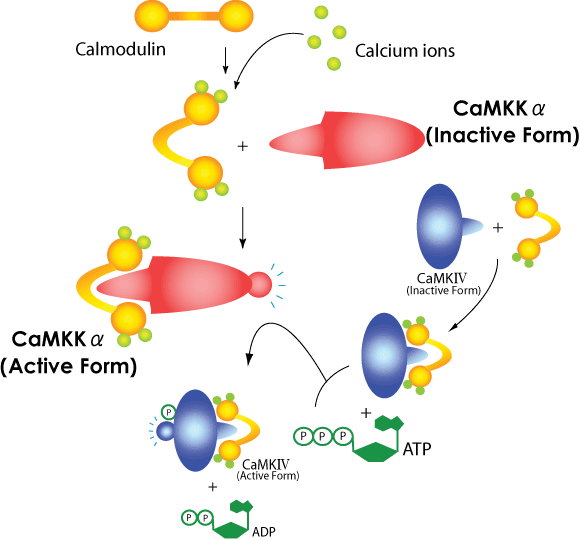
丂丂丂変乆偼丆擼撪僾儘僥僀儞僉僫乕僛僇僗働乕僪偺峔惉梫慺偺堦偮偱偁傞CaMKK兛偺X慄寢徎峔憿夝愅傪栚巜偟偰丆偙偺僞儞僷僋幙偺惛惢丆寢徎壔傪帋傒偰偄傞丏幚尡偵梡偄偰偄傞CaMKK兛偼儔僢僩戝擼旂幙桼棃偺傕偺偱丆傾儈僲巁巆婎悢505丆暘巕検栺56k偺僞儞僷僋幙偱偁傞丏杮暘巕偼僇儖儌僕儏儕儞寢崌偵娭梌偡傞挷愡椞堟偲怗攠椞堟偐傜峔惉偝傟偰偄傞丏僇儖僔僂儉僀僆儞偺寢崌偟偨僇儖儌僕儏儕儞偑挷愡椞堟偵寢崌偡傞偙偲偵傛偭偰妶惈壔偝傟丆ATP傪巊偭偰CaM僉僫乕僛丒傪儕儞巁壔偡傞乮恾-2乯丏
恾-2
 |
 |
| 恾-3 |
恾-4 |
丂丂丂CaMKK兛偼乽悈梟惈僞儞僷僋幙偱偼偁傞偑丆惛惢搙偑忋偑傞偲傾僌儕僎乕僩偟傗偡偄乿偲偄偆惈幙傪帩偭偰偍傝丆寢徎壔偡傞偺偑崲擄偱偁傞丏尰抜奒偱偼旝寢徎偼摼偰偄傞偑丆寢徎峔憿夝愅偵揔偟偨寢徎偼摼傜傟偰偄側偄丏恾-3偵Tween80傪揧壛偟偰惛惢偟偨CaMKK兛偺旝寢徎偲偦偺夞愜憸傪帵偡丏傑偨恾-4偵僉儌僩儕僾僔儞張棟偟偨帋椏偵偮偄偰偺寢壥傪帵偡丏杮帋椏偼乽僇儖僔僂儉僀僆儞媦傃僇儖儌僕儏儕儞偺懚嵼壓偱帺屓儕儞巁壔偑婲偙傞乿偙偲傕妋擣偝傟偰偄傞丏偙偺惈幙傕寢徎壔傪崲擄偵偟偰偄傞尨場偺傂偲偮偲傕峫偊傜傟偰偄傞丏CaMKK兛偺椙幙偺寢徎傪摼傞偨傔偵尰嵼変乆偼埲壓偺愴棯偱寢徎壔傪帋傒偰偄傞丏
丂丂丂侾丂僾儘僥傾乕僛偱徚壔偟偨昗昳偺挷惢
丂丂丂俀丂傾僌儕僎乕僩傪杊偖偨傔偺奅柺妶惈嵻偺専摙
丂丂丂俁丂僇儖儌僕儏儕儞-CaMKK兛暋崌懱偺挷惢
丂丂丂係丂儕儞巁壔晹埵傪曄堎偝偣偨CaMKK兛偺挷惢
丂丂丂俆丂儌僲僋儘乕僫儖峈懱偺挷惢偲丆CaMKK兛
-峈懱暋崌懱偺挷惢
丂丂丂杮尋媶偼帬夑導棫惉恖昦僙儞僞乕偺摗郪恗尋媶幒偲偺嫟摨尋媶僾儘僕僃僋僩偱偁傞丏

Axin
丂丂丂Axin偼懱愡宍惉丆懱幉宍惉丆嵶朎偺暘壔丒暘楐側偳傪惂屼偡傞Wnt僔僌僫儖揱払宯傪峔惉偡傞僞儞僷僋幙偺堦偮偱偁傝丆堚揱巕敪尰傪惂屼偡傞摥偒傪桳偡傞兝-catenin偺嵶朎幙撪擹搙傪惂屼偡傞僞儞僷僋幙偲偟偰抦傜傟偰偄傞丏兝-catenin偼Axin偲捈愙寢崌偡傞偙偲偱GSK-3兝僉僫乕僛偵傛傞儕儞巁壔傪庴偗丆嵟廔揑偵儐價僉僠儞壔傪宱偰僾儘僥傾僜乕儉偵傛傝暘夝偝傟傞丏Axin偵偼兝-catenin偲GSK-3兝埲奜偵傕adenomatous
plolyposis coli堚揱巕嶻暔乮APC乯偲偺暋崌懱傪宍惉偟丆偦傟偧傟Axin忋偵偍偗傞寢崌晹埵偼傎傏柧傜偐偵側偭偰偄傞偑暋崌懱偲偟偰偺徻嵶側婡擻偼晄柧偱偁傞丏偦傟傪夝柧偡傞偨傔偵偼Axin偺棫懱峔憿偑昁梫偱偁傝丆偦傟傪倃慄寢徎峔憿夝愅朄偵傛偭偰柧傜偐偵偟丆兝-catenin偺擹搙惂屼婡峔偵偍偗傞Axin偺摥偒傪夝柧偡傞偙偲傪栚揑偲偡傞丏
丂丂丂兝-catenin偺擹搙堎忢偼嵶朎暘壔堎忢傪堷偒婲偙偟丆惉弉嵶朎偱偼娻壔傪堷偒婲偙偡尨場偲側傞丏Axin偲寢崌偡傞僞儞僷僋幙孮偺堎忢偑
兝-catenin偺擹搙堎忢傪堷偒婲偙偡偙偲偱娻壔偑堷偒婲偙偝傟傞偙偲偑帵嵈偝傟偰偄傞丏Axin偺峔憿夝柧偼偦偺傛偆側嵶朎偺娻壔婡峔傪夝偒柧偐偡庤偑偐傝偲側傞丏
丂丂丂摉尋媶幒偱偼嵟嬤Axin偺C枛抂偵偁傞DIX僪儊僀儞偺寢徎壔偵惉岟偟丆X慄峔憿壔妛揑尋媶傪悇偟恑傔偰偄傞丏
丂丂丂杮尋媶偼峀搰戝妛堛妛晹偺媏抮尋媶幒偲偺嫟摨尋媶偱偁傞丏

僇僪僿儕儞條恄宱庴梕懱
岺帠拞

懠偺僾儘僥僀儞僉僫乕僛
岺帠拞
|